Wie Abiomed (NASDAQ: ABMD) mitteilte, hat das Unternehmen bei der Entwicklung von kleineren Zugängen für die Impella-Herzpumpe zwei Meilensteine erreicht. Die Impella ECP Herzpumpe hat die erste Stufe der frühen Machbarkeitsstudie (EFS) der US-amerikanischen Arzneimittelaufsichtsbehörde FDA abgeschlossen und die FDA hat die 510(k)-Zulassung für die Einführschleuse Impella XR Sheath erteilt.
Diese Pressemitteilung enthält multimediale Inhalte. Die vollständige Mitteilung hier ansehen: https://www.businesswire.com/news/home/20201216005701/de/
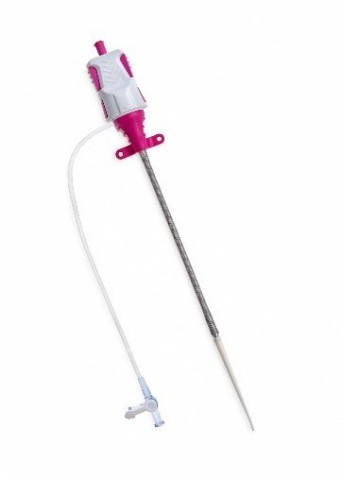
The Impella XR sheath inserts at 10 Fr, momentarily expands during Impella delivery, then recoils. (Photo: Business Wire)
Die Einführschleuse Impella XR Sheath mit schmalem Profil dehnt sich aus und zieht sich zurück, um so einen kleinkalibrigen Zugang und Verschluss mit der Impella 2.5 Herzpumpe zu erlauben. Nach dem Einführen bei einem Durchmesser von 10 Charrière (Ch) dehnen sich die flexiblen Nitinol-Geflechte während der Impella Positionierung vorübergehend aus und ziehen sich anschließend zurück. Hierdurch wird der Zugang für komplexe Eingriffe vereinfacht. Die Impella XR Sheath Einführschleuse wurde entwickelt, um im Vergleich zu Einführschleusen größeren Kalibers das Trauma an der arteriellen Zugangsstelle zu minimieren.
Die Impella XR Sheath Einführschleuse wurde bereits mehrfach an Patienten außerhalb der USA erprobt. Die Behandlung des ersten Patienten in den USA wird für das vierte Quartal des Geschäftsjahres 2021 erwartet.
Zudem hat Abiomed mit der Behandlung von fünf Patienten die erste Phase der frühen Machbarkeitsstudie (EFS) der Impella ECP Herzpumpe erfolgreich abgeschlossen. Impella ECP ist die kleinste Herzpumpe der Welt. Sie hat beim Einführen und Herausnehmen aus dem Körper einen Durchmesser von 9 Charrière (Ch). Im Herzen dehnt sie sich aus, während sie die Pumpfunktion des Herzens unterstützt und Spitzenvolumenströme von mehr als 3,5 l/min erreicht.
Die prospektive, multizentrische, nicht randomisierte frühe Machbarkeitsstudie soll es Abiomed, den beteiligten Ärzten und der FDA ermöglichen, qualitative Bewertungen der Sicherheit und Machbarkeit der Anwendung von Impella ECP bei Hochrisikopatienten während einer perkutanen Koronarintervention (PCI) vorzunehmen. Abiomed wird nun die erhobenen Daten bei der FDA einreichen und den Start einer zweiten Phase der Studie mit erweiterter Patientenanmeldung beantragen.
„Diese Meilensteine sind wichtige Etappen bei der Umsetzung unserer Vision, ein innovatives Portfolio von Produkten aufzubauen, die kleiner, intelligenter und besser vernetzt sind“, so Dr. med. Chuck Simonton, Chief Medical Officer bei Abiomed. „Innovative Konzepte wie Impella ECP und Impella XR Sheath ermöglichen kleinere Zugangsstellen bei der Anwendung von Impella und verbessern auf diese Weise die Patientenversorgung und Behandlungsergebnisse.“
Impella ECP ist nur für Forschungszwecke und nicht für die Anwendung außerhalb klinischer Studien zugelassen.
ÜBER ABIOMED
Abiomed, Inc. mit Sitz in Danvers, Massachusetts (USA), ist ein führender Anbieter von Medizintechnik zur Kreislaufunterstützung. Unsere Produkte sollen die Entlastung des Herzens durch die Verbesserung der Durchblutung und/oder die Übernahme der Pumpfunktion des Herzens ermöglichen. Weitere Informationen sind abrufbar unter: www.abiomed.com.
ÜBER IMPELLA XR SHEATH
Impella XR Sheath ist für die perkutane Einführung des Impella 2.5-Katheters und zusätzlicher Geräte vorgesehen.
ÜBER IMPELLA ECP
WARNHINWEIS: Die Impella ECP ist ein Gerät in der Erprobung, das laut US-Bundesgesetzen auf Anwendungen zu Forschungszwecken beschränkt ist.
ÜBER IMPELLA HERZPUMPEN
Impella 2.5® und Impella CP® sind von der FDA für die Behandlung von Patienten mit bestimmten fortgeschrittenen Herzerkrankungen zugelassen, die einer elektiven oder dringlichen perkutanen Koronarintervention (PCI: Percutaneous Coronary Intervention) wie z. B. Stentimplantation oder Ballon-Angioplastie unterzogen werden.
Impella 2.5, Impella CP, Impella CP mit SmartAssist®, Impella 5.0®, Impella LD® und Impella 5.5® mit SmartAssist® sind von der FDA zur Behandlung von Herzinfarkt- oder Kardiomyopathie-Patienten mit kardiogenem Schock zugelassen. Diese einzigartigen Herzpumpen ermöglichen eine Wiederherstellung der nativen Herzfunktion, sodass die Patienten mit ihrem eigenen Herzen nach Hause entlassen werden können.
ZUKUNFTSGERICHTETE AUSSAGEN
Diese Pressemitteilung enthält Aussagen, die sich auf die Zukunft beziehen. Zukunftsgerichtete Aussagen unterliegen Risiken und Ungewissheiten, wie sie in den periodischen Berichten von Abiomed, die bei der Securities and Exchange Commission hinterlegt sind, beschrieben werden. Die tatsächlichen Ergebnisse können erheblich von den erwarteten Ergebnissen abweichen.
Die Ausgangssprache, in der der Originaltext veröffentlicht wird, ist die offizielle und autorisierte Version. Übersetzungen werden zur besseren Verständigung mitgeliefert. Nur die Sprachversion, die im Original veröffentlicht wurde, ist rechtsgültig. Gleichen Sie deshalb Übersetzungen mit der originalen Sprachversion der Veröffentlichung ab.
Originalversion auf businesswire.com ansehen: https://www.businesswire.com/news/home/20201216005701/de/

